在FDA要求联邦调查阿尔茨海默氏症药物批准后Biogen股价下跌
生物遗传股呼吁调查,近期该公司的阿尔茨海默氏症的药物,Aduhelm批准的食品和药物管理局的负责人后,上周五下跌。
在 6 月 7 日该药物获得批准之前,代理 FDA 专员珍妮特伍德科克博士要求监察长办公室调查美国机构与百健代表之间的互动。
“我认为,由监察长办公室等独立机构审查相关事件至关重要,以确定百健与 FDA 审查人员之间发生的任何互动是否与 FDA 政策和程序不一致,”伍德科克在周五寄出的一封信中写道。
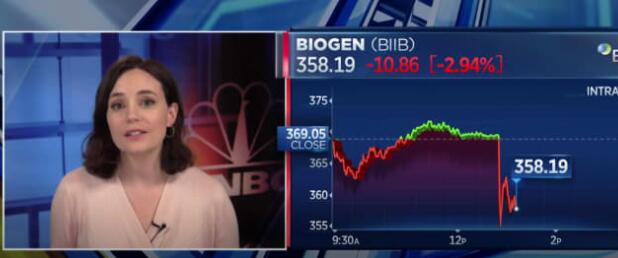
公告发布后,百健 (Biogen) 的股价下跌了 3% 以上。
在 FDA 批准了这家生物技术公司的药物后,Biogen 的股票上个月飙升,这是美国监管机构批准的第一种药物,用于减缓阿尔茨海默氏症患者的认知能力下降,也是近 20 年来第一种治疗该疾病的新药。
该决定标志着该机构独立外部专家小组的建议背离了该小组的建议,该小组去年秋天出人意料地拒绝认可该药物,理由是数据不可信。在获得该机构的批准后,该小组的至少三名成员已辞职以示抗议。
联邦监管机构面临着来自阿尔茨海默病患者的朋友和家人的巨大压力,他们要求快速追踪这种药物,科学上称为 aducanumab。STAT News 和其他媒体报道称,FDA 官员使用监管捷径获得批准,以便更快地将该药物推向市场。
百健(Biogen)的药物靶向大脑中一种称为β-淀粉样蛋白的“粘性”化合物,科学家们预计这种化合物在破坏性疾病中发挥作用。
很少有 FDA 负责人要求对该机构自己的决定进行调查。这是该公司和该药物的最新挫折,自 2016 年显示出前景以来一直存在争议。
2019 年 3 月,在一个独立小组的分析显示该药物不太可能奏效后,百健(Biogen)停止了该药物的开发。几个月后,该公司宣布最终将寻求监管部门的批准,这让投资者感到震惊。
当百健 (Biogen) 在 2019 年底寻求批准该药物时,其科学家表示,对更大数据集的新分析显示,aducanumab“减少了早期阿尔茨海默病患者的临床下降”。
阿尔茨海默病专家和华尔街分析师立即表示怀疑,有些人怀疑临床试验数据是否足以证明该药物有效,以及批准是否会使其他公司更难招募患者参加自己的药物试验。
一些医生表示,由于支持该公司申请的混合数据包,他们不会开出aducanumab。